
「医线」是创业邦推出的医疗健康系列栏目,立足医疗健康一线,捕捉行业内最新动态,洞察创投新趋势。
医线周报,为你挑选过去一周(12.3~12.11)最值得关注的「医线」新闻
整理 | 宇哲
Part.1
一周投融资
本周全球医疗健康领域融资事件共54起,其中国内24起,国外30起。据睿兽分析不完全统计,本周国内医疗融资金额总计超53亿人民币,海外融资金额总计超5亿美元。


数据来源:睿兽分析
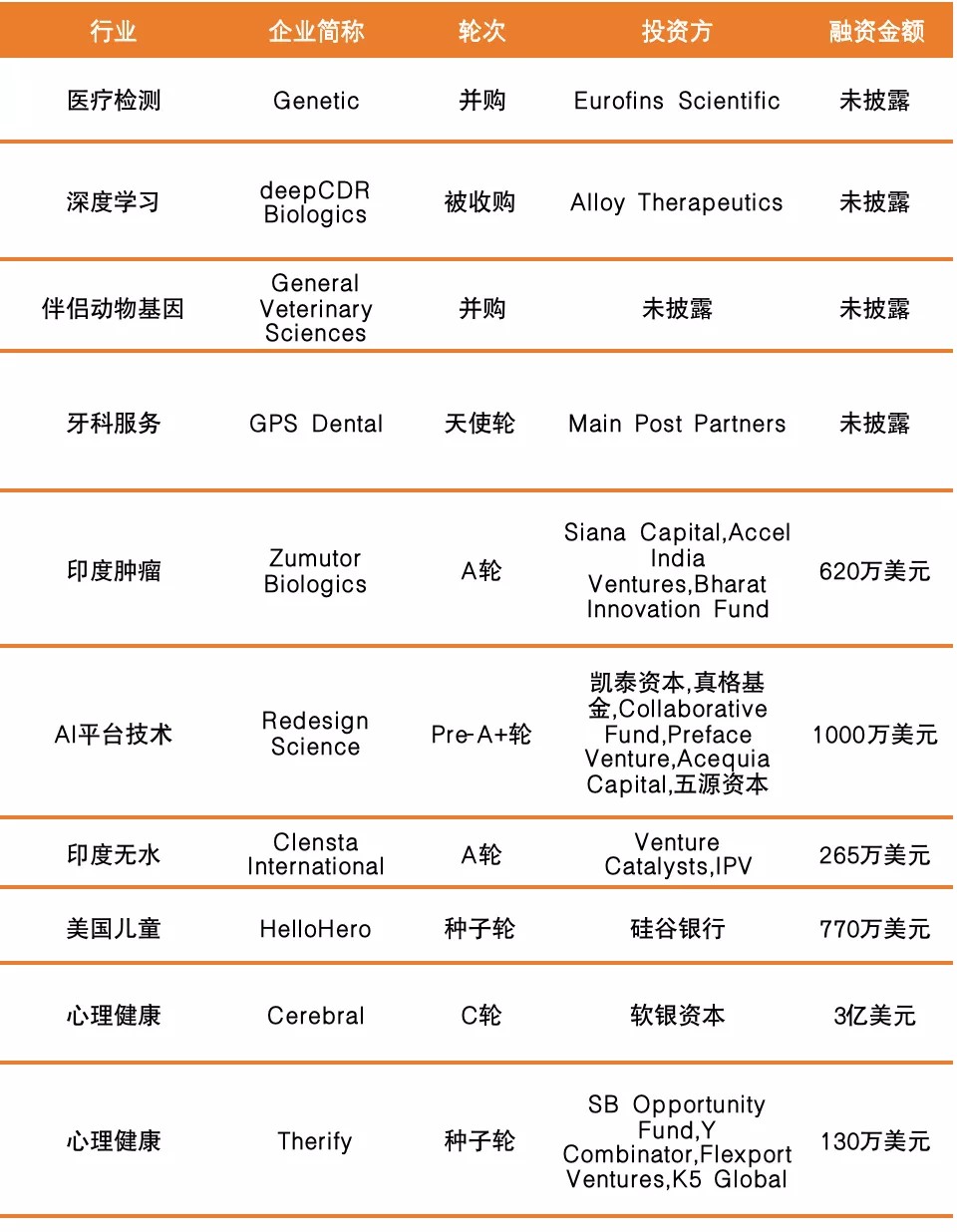
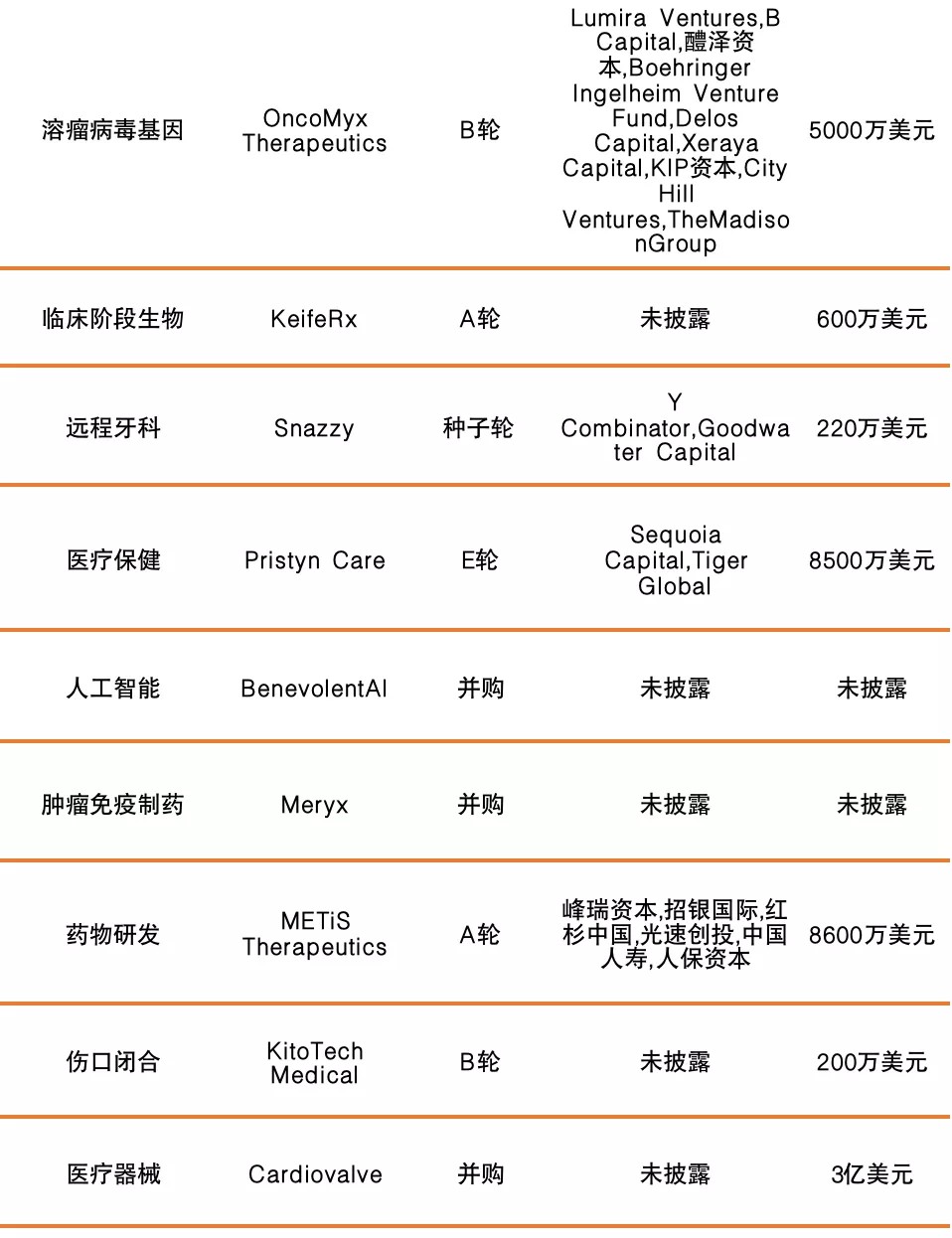
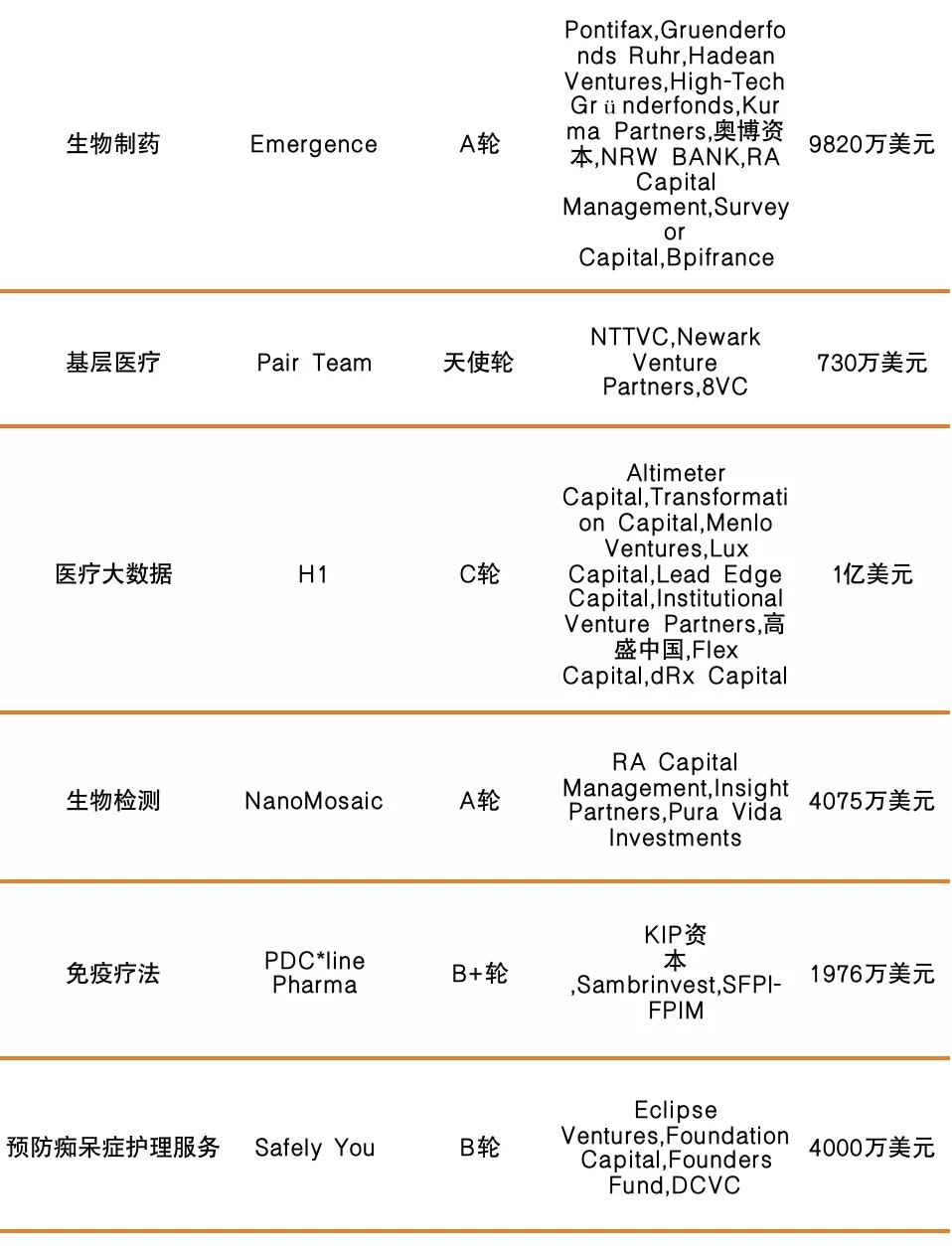
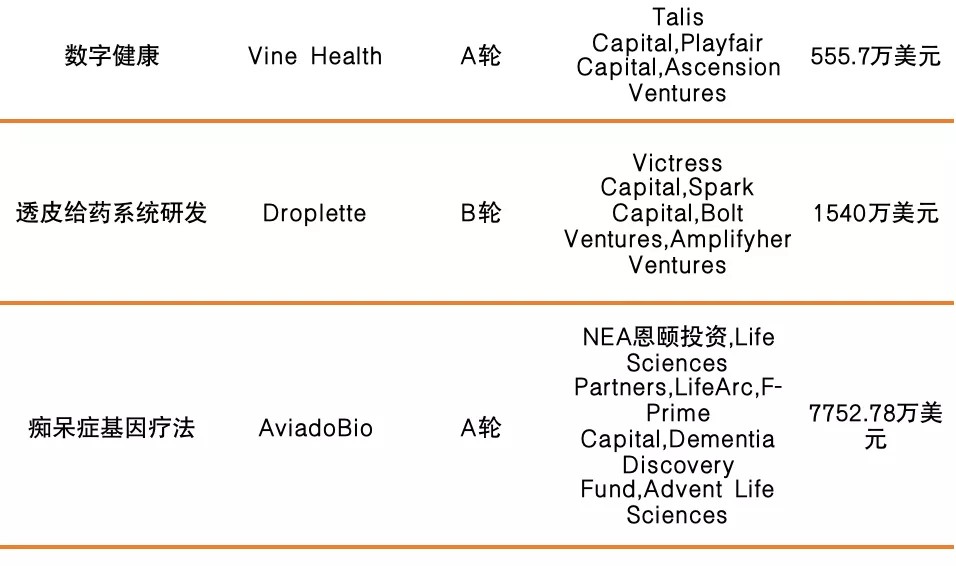
本周国内融资超1亿人民币的公司信息如下:
简单心理网是一个主打心理咨询服务的网络平台,一方面帮助人们更好的找到适合自己的心理咨询师;另一方面则帮助心理咨询师们交流心理学心得。
鞍石生物专注于抗肿瘤创新药物的研发,拥有丰富的药物研发管线,涵盖肺癌、脑胶质瘤等多个肿瘤治疗领域。
博奥信面向全球临床需求,聚焦疾病耐药、复发、残留三大难题,致力于开发新一代创新抗体药物。基于其专有的H³(高通量,高含量,高效率)单抗筛选平台,SynAbTM协同抗体技术平台、SynTracerTM 高通量抗体内吞筛选平台、以及FlexibodyTM双特异抗体技术平台,通过自主创新与合作开发两种模式加速推进其创新抗体药物管线。
阿吉安是一家高端生殖科学技术研发商,专注于胚胎植入前遗传诊断和胚胎领域。
爱博泰克成立于2011年,是国内生命科学工具领导品牌,尤其在试剂原料领域具备突出的产品研发、迭代及生产能力。
目前湖南同健大药房连锁有限公司拥有十余家直营店,跨区域销售,除了做传统的药房零售外,还主要针对享有特殊病种待遇的医保病人开展服务工作。
浙江健新原力制药有限公司,是一家致力于肿瘤创新药和仿制药多药联合的药品研发和药品制造企业。
国外融资情况如下:

Part.2
一周政策动向
NMPA于11月批准注册187个医疗器械产品
10日,NMPA发布公告称,NMPA于11月共批准注册医疗器械产品187个。其中,境内第三类医疗器械产品131个,进口第三类医疗器械产品22个,进口第二类医疗器械产品32个,港澳台医疗器械产品2个。(NMPA)
CDE发布3个抗新冠病毒药物相关技术指导原则
7日,CDE发布《抗新冠病毒化学药物非临床药效学研究与评价技术指导原则(试行)》《抗新冠病毒肺炎炎症药物非临床药效学研究与评价技术指导原则(试行)》《新型冠状病毒中和抗体类药物非临床研究技术指导原则(试行)》,自发布之日起施行。(CDE)
CDE《基因治疗产品长期随访临床研究技术指导原则》
近日,CDE官网发布《基因治疗产品长期随访临床研究技术指导原则》。该指导原则针对基因治疗长期随访临床研究的观察方法和研究设计进行讨论,着重阐述了基因治疗长期随访临床研究的观察目的、考虑要素、设计实施以及不同基因治疗产品的特殊考虑等相关要求,在为该类产品开展长期随访临床研究提供技术指导,确保及时收集迟发性不良反应的信号,识别并降低这类风险,同时获取这类产品长期安全性和有效性的信息。(CDE)
Part.3
大公司&大事件
金陵药业拟取得东升药业不低于55%股权
6日,金陵药业发布公告称,公司与洪荷芳、柯善治等自然人、艾德凯腾和东升药业于近日签署框架协议,公司拟通过增资及股权受让方式,取得东升药业不低于55%的股权。(企业公告)
证监会同意迈威生物科创板IPO注册
7日,证监会发布公告称,同意迈威生物在科创板首次公开发行注册,海通证券为主承销商。此次迈威生物科创板IPO计划募资29.8亿元,其中12亿元用于年产1000kg抗体产业化建设项目,10亿元用于抗体药物研发,7.8亿元用于补充流动资金。(证监会)
四家药企上市,三家开盘破发
10日,四家医药企业成功上市,分别是凯莱英、北海康成、固生堂和迪哲医药。其中,前三家在港交所主板挂牌上市,迪哲医药在上交所科创板上市。除固生堂之外,其余三家开盘破发,最大跌幅近30%,北海康成和凯莱英的上市直播庆祝仪式也紧急暂停。(新浪医药新闻)
Part.4
新产品&新技术
海思科环泊酚新适应症获批上市
10日,NMPA官网显示,海思科环泊酚注射液新适应症获批上市。本次获批的适应症应为:纤支镜诊疗镇静/麻醉、重症监护期间镇静、成人手术全身麻醉。(NMPA)
默沙东叫停抗艾滋病药物islatravir两项临床试验
近日,默沙东宣布将暂停两项用于评估抗艾滋病药物islatravir的三期试验的患者招募。此项决定是在接受islatravir暴露前预防的外部数据监察委员会的建议后,默沙东暂停招募IMPOWER 22与IMPOWER 24临床试验,以便公司开展的对这些研究的进一步分析。(新浪医药)
先声药业CDK4/6抑制剂曲拉西利拟纳入优先审评
8日,CDE最新公示显示,先声药业CDK4/6抑制剂曲拉西利注射液符合附条件批准的药品被纳入优先审评审批程序。拟定适应症为在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌患者中预防性使用曲拉西利,以降低化疗引起的骨髓抑制的发生率。(CDE)
默沙东15价肺炎球菌疫苗获优先审评资格
近日,默沙东宣布,FDA已授予15价肺炎球菌结合疫苗Vaxneuvance的补充生物制品许可申请优先审评资格,用于帮助6周至17岁儿童预防侵袭性肺炎球菌导致的疾病。(药明康德)
“first-in-class”贫血疗法获FDA优先审评资格
近日,百时美施贵宝旗下新基宣布,FDA已授予“first-in-class”血红细胞成熟剂Reblozyl的补充生物制品许可申请优先审评资格,用于治疗非输血依赖性β地中海贫血成人患者。(药明康德)
Part.5
言论&数据
PROTAC项目ARV-471最新临床数据公布,安全性优势明显
10日,在第44届美国圣安东尼奥乳腺癌研讨会上,ARV-471更新了首次在ER+/HER2-局部晚期或转移性乳腺癌患者中的安全性和活性数据。研究采用常规的3+3剂量递增研究,评估口服ARV-471在绝经前/后女性ER+/HER2-局部晚期或转移性乳腺癌患者中的的安全性、药代动力学、药效学和初步抗肿瘤活性。所有患者既往接受过CDK4/6抑制剂治疗,80%接受过氟维司群治疗,78%接受过既往化疗。疗效方面,在47名可评估临床获益的患者中,ARV-471治疗的临床受益率为40%。其中,3例达到PR,ORR为7.89%。14例患者仍在继续接受研究治疗,包括2名接受治疗超过18个月的患者。(医药魔方)








