
「医线」是创业邦推出的医疗健康系列栏目,立足医疗健康一线,捕捉行业内最新动态,洞察创投新趋势。
医线周报,为你挑选过去一周(3.26-4.1)最值得关注的「医线」新闻
整理丨宇 哲
编辑丨及轶嵘
Part.1
一周投融资
本周全球医疗健康领域融资事件共32起,其中国内22起,国外10起。据睿兽分析不完全统计,本周国内医疗融资金额总计超23亿人民币,海外融资金额总计近57亿美元。
数据来源:睿兽分析
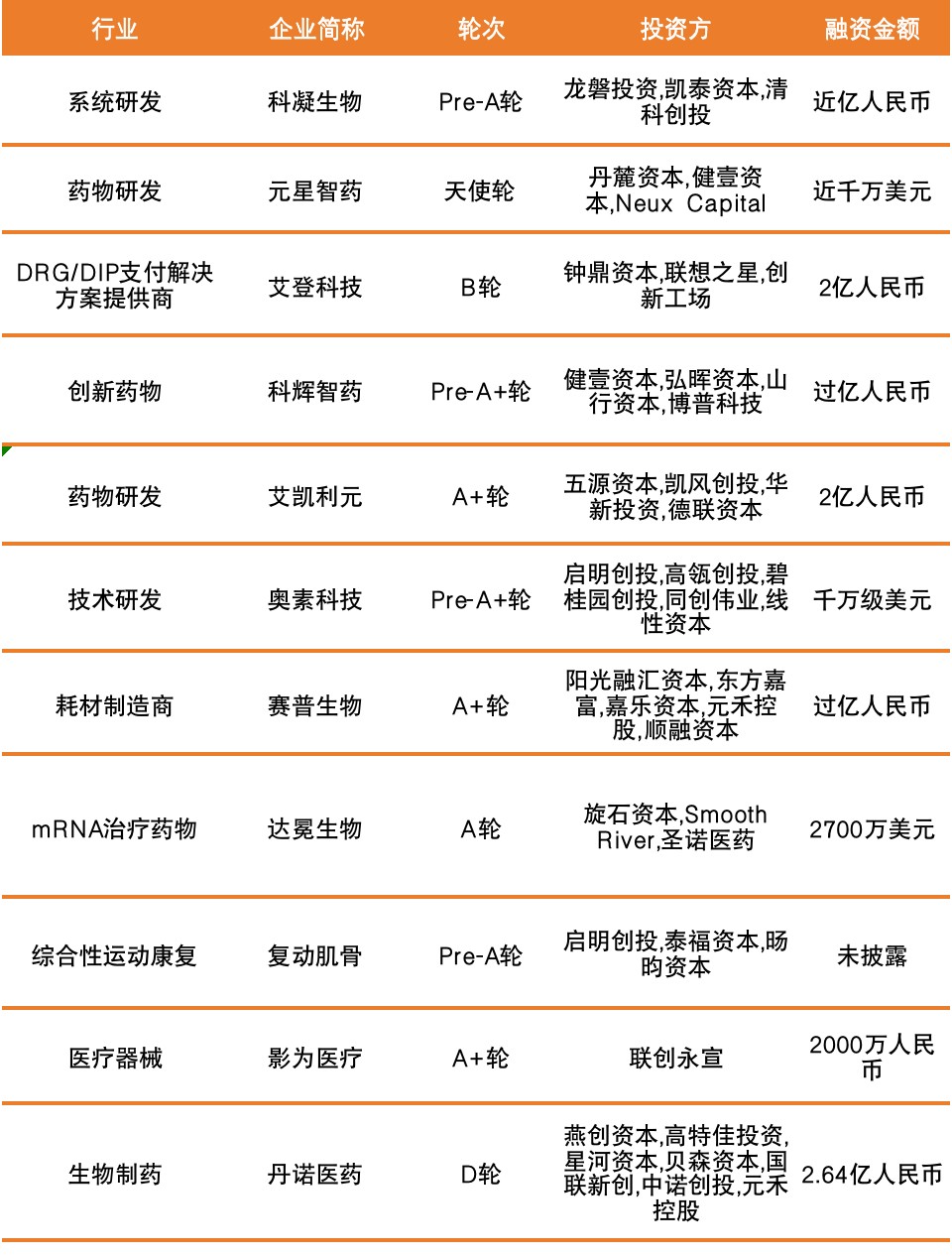
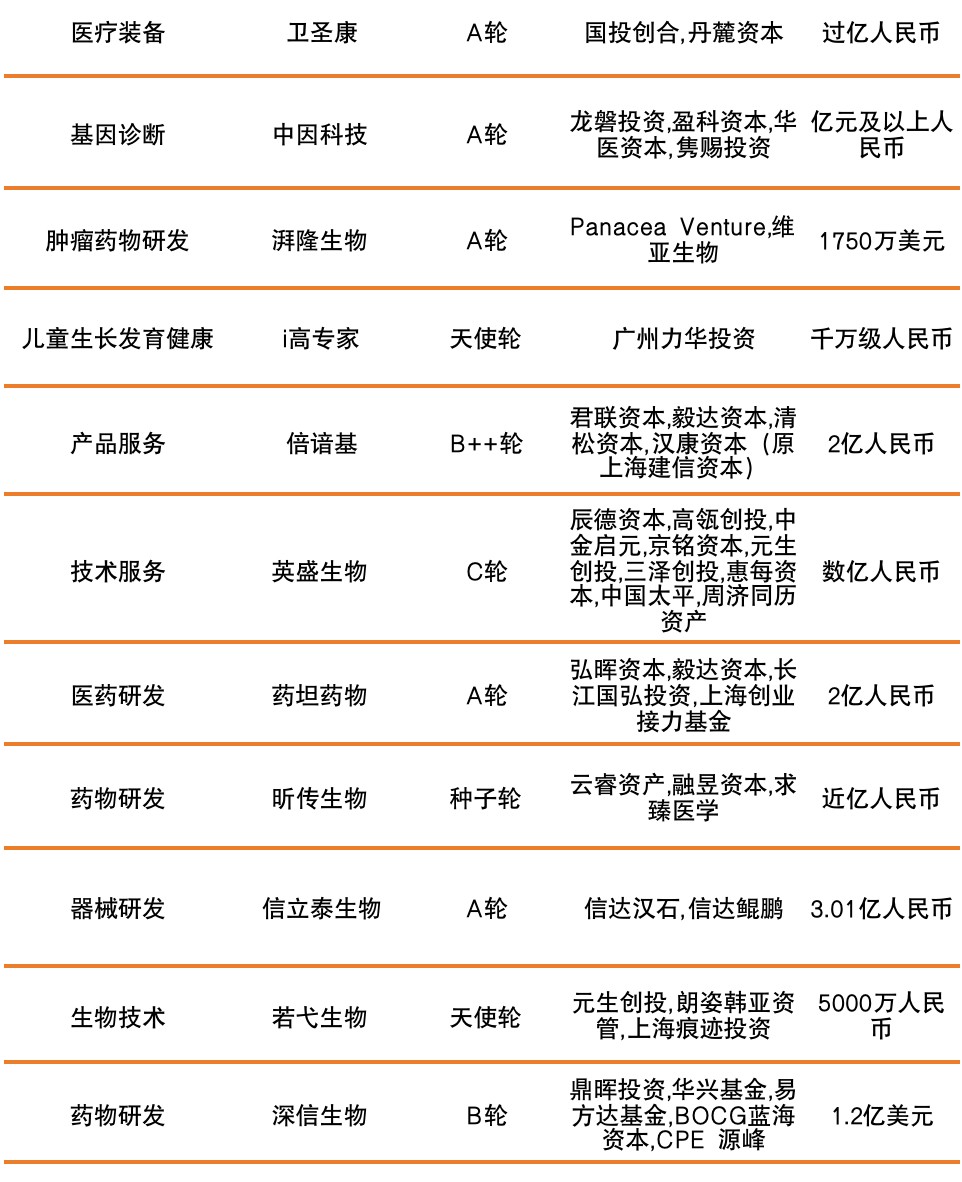
本周国内融资超1亿元人民币的公司信息如下:
艾登科技成立于2016年,以“人工智能”、“疾病分类”与“病案质控”为切口,专注于医疗行业内大数据深度挖掘以及人工智能应用,为近4000家二三级公立医院及其他卫生医药机构提供基于DRG/DIP的医疗服务效率评价、医保资金支付、成本核算与绩效分配、临床路径与学科建设等方面的解决方案。
艾凯利元是一个新一代通用现货型细胞治疗药物研发商,秉承“以临床需求为导向,开展以患者为核心的药物研发”的宗旨,目前已在iPSC重编程、基因编辑、干细胞分化等方面形成了深厚的技术积累,并在iPSC领域取得了一系列原创性的突破成果。
苏州赛普生物科技有限公司是一家细胞培养耗材制造商,定位于高端生物耗材的研发、生产和销售,专注于分子诊断、细胞培养、细胞免疫治疗等耗材,以分子诊断耗材为主,以细胞培养耗材为辅。
丹诺医药是一家生物制药研发商,专门从事治疗消化道感染的新药研发﹑生产与销售的创新型生物制药企业。目前针对中国医药市场的迫切需求对该产品进行开发,防治由幽门螺杆菌感染引起的慢性胃炎、胃溃疡和胃癌等消化道疾病,从根本上解决现有标准三联药或四联药方案所存在的耐药性等重大问题。
卫圣康医学科技(江苏)有限公司成立于2020年4月,总部坐落江苏省苏州市昆山开发区,工厂占地面积38000平方,研发中心和销售中心位于上海。是一家专注ICU全线治疗设备的研发、生产和销售于一体的公司,公司以国际最前沿的创新技术,通过高度满足临床需求的创新产品,填补国内空白,实现进口产品替代,造福人类健康、治愈疾患、减轻疾苦。
上海倍谙基生物科技有限公司在上海市政府支持下由华东理工大学谭文松教授创立的成果转化平台,主要从事动物细胞大规模高密度无血清悬浮培养技术的创新研发和应用服务、个性化无血清培养基等关键原材料及生物反应器等关键装备的设计开发和国产化生产制造,为抗体、重组蛋白、人畜禽病毒疫苗、细胞治疗等生物医药产品的中试孵化、产业化和工业化生产提供技术支撑、技术服务及关键原材料和装备保障。
信立泰生物是一家医疗器械研发生产商,主营业务为从事II类、III类医疗器械的生产和研发,旨在为用户提供全方位的服务。
深信生物是一家mRNA药物研发商,主要从事基于脂质体纳米颗粒载体递送技术的mRNA药物研发和商业化。
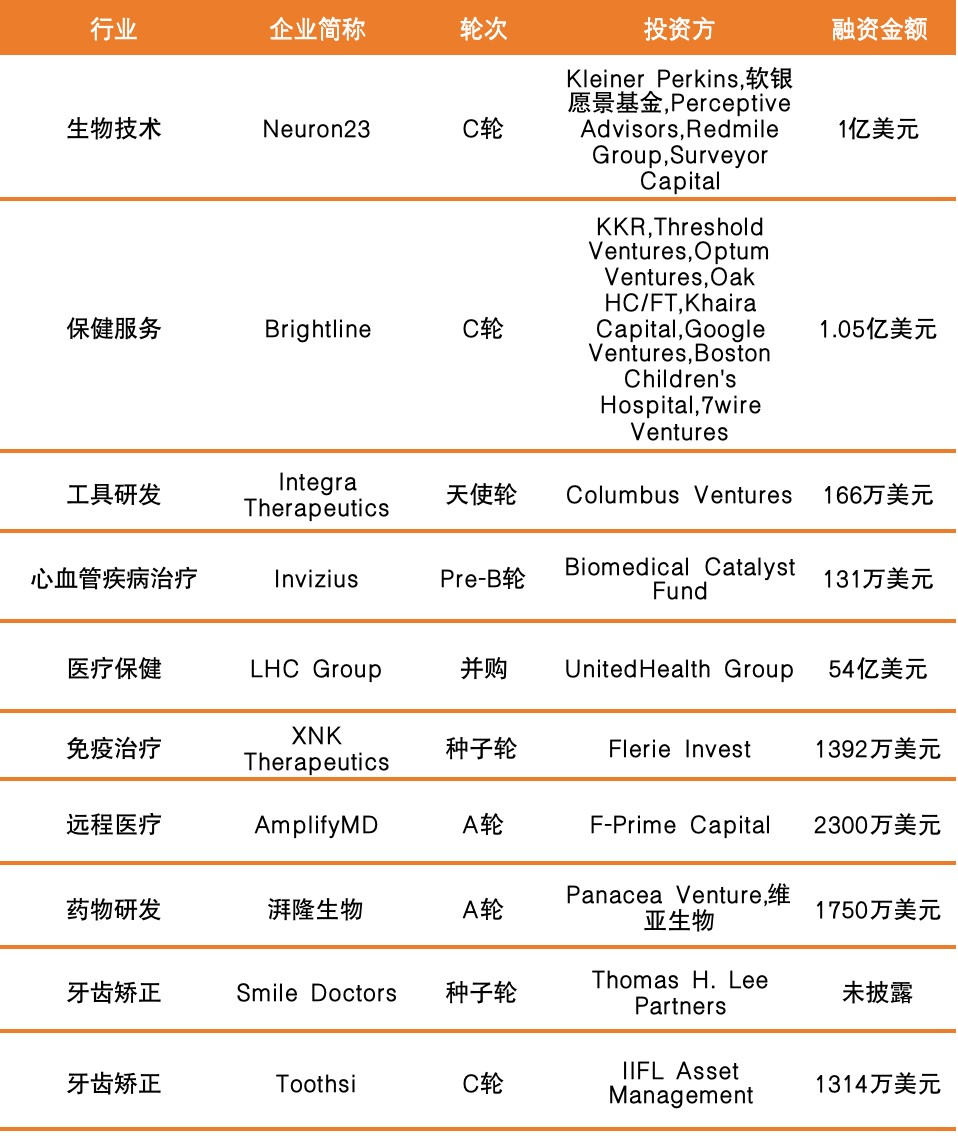
国外融资情况如下:
数据来源:睿兽分析
Part.2
一周政策动向
国家医保局发布耗材带量采购文件
31日,国家医保局发布《国家医保局办公室 国家卫健委办公厅关于国家组织高值医用耗材(人工关节)集中带量采购和使用配套措施的意见》。该份内容通知主体为各省、自治区、直辖市及新疆生产建设兵团医保局、卫生健康委。该《意见》针对人工关节采购、配送、使用及伴随服务的特殊特点,对中选产品挂网、供应、配送,医保支付政策,医疗服务价格调整、结余留用,后续监管重点和惩处措施等各项带量采购落地细节和配套措施进行规范。(国家医保局)
第三批津冀新冠抗原检测试剂挂网采购价格公布
30日,天津市医药采购中心公布第三批津冀新冠抗原检测试剂挂网采购价格。其中,乐普诊断新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)为9元/人份,万孚生物为7.9元/人份。(天津市医药采购中心)
国家卫健委就《临床急需药品临时进口工作方案》公开征求意见
29日,国家卫健委同国家药监局就《临床急需药品临时进口工作方案》和《氯巴占临时进口工作方案》公开征求意见。《临床急需药品临时进口工作方案》适用于国内无注册上市、无企业生产或短时期内无法恢复生产的境外已上市临床急需少量药品。其中,临床急需少量药品为符合下列情形之一的药品:用于治疗罕见病的药品;用于防治严重危及生命疾病,且尚无有效治疗或预防手段的药品;用于防治严重危及生命疾病,且具有明显临床优势的药品。(国家卫健委)
Part.3
大公司&大事件
荣昌生物登陆科创板,开盘破发
31日,荣昌生物正式登陆科创板,实现“A+H”两地上市。科创板IPO首日,N荣昌(688331)开盘报46.00元/股,较发行价下跌4.17%。截至收盘,N荣昌报40.84元/股,跌14.92%。(新浪医药)
瑞科生物登陆港交所
今日,瑞科生物正式登陆香港证券交易所。每股定价24.80港元,每手500股。公开发售阶段瑞科生物获约10.65倍认购,一手中签率9.28%。截至收盘,报25.250港元/股,涨1.81%。(新浪医药)
中国医药午后炸板闪崩跌超9%
31日,医药板块龙头中国医药午后炸板,随后股价持续下挫。截止收盘,中国医药逼近跌停,报36.36元/股,跌9.64%。成交额108.9亿元,换手率24.91%。此前,自3月1日至今,股价从11元涨到了40元左右,区间涨幅已超250%。(新浪医药)
Part.4
新产品&新技术
辉瑞、莫纳德第四剂新冠疫苗紧急使用获FDA授权
日前,辉瑞发布公告称,与BioNTech联合研发的新冠疫苗已获得FDA授权扩大其紧急使用范围,特定人群可接种此款疫苗第二剂加强针,第二剂加强疫苗注射时间与第一剂至少要间隔四个月。这些人群包括:50岁及以上的人群;12岁及以上免疫功能低下的人群。同一日,莫德纳新冠疫苗第二剂加强针用于50岁及以上人群、18岁及以上免疫力低下人群也获得了FDA授权紧急使用。(新浪医药)
创新FGFR抑制剂治疗胆管癌获FDA优先审评资格
今日,日本大鹏药品和旗下Taiho Oncology宣布,美国FDA已经接受futibatinib的新药申请,用于治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌经治患者。(药明康德)
优时比Fintepla获FDA批准拓展适应症
28日,优时比宣布,美国FDA已批准Fintepla(fenfluramine,芬氟拉明)扩展适应症,用于治疗两岁及以上患者与Lennox-Gastaut综合征(LGS)相关的癫痫发作。(药明康德)
诺诚健华TYK2 JH2变构抑制剂ICP-488获批临床
28日,诺诚健华宣布,公司收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,其自主研发的TYK2 JH2变构抑制剂ICP-488已获批开展临床试验,成为公司在自身免疫性疾病领域第三个进入临床阶段的创新药。(美通社)
Part.5
言论&数据
国家药监局、卫健委联合发布《医疗器械临床试验质量管理规范》
31日,国家药监局发布公告称,国家药品监督管理局会同国家卫生健康委员会组织修订了《医疗器械临床试验质量管理规范》。适用的范围为:在中华人民共和国境内,为申请医疗器械(含体外诊断试剂)注册而开展的医疗器械临床试验的相关活动应当遵守《规范》。《规范》涵盖医疗器械临床试验全过程,包括医疗器械临床试验的方案设计、实施、监查、稽查、检查,数据的采集、记录、保存、分析、总结和报告等。(国家药监局)
所有对本栏目感兴趣的朋友,可扫描以下二维码或添加微信nvxiaoyuyu进群交流,感谢大家。

本文为创业邦原创,未经授权不得转载,否则创业邦将保留向其追究法律责任的权利。如需转载或有任何疑问,请联系editor@cyzone.cn。








