
「医线」是创业邦推出的医疗健康系列栏目,立足医疗健康一线,捕捉行业内最新动态,洞察创投新趋势。
医线周报,为你挑选过去一周(6.12~6.18)最值得关注的「医线」新闻
整理 | 宇哲
Part.1
一周投融资
本周全球医疗健康领域融资事件共36起,其中国内20起,国外16起。据睿兽分析不完全统计,本周国内医疗融资金额总计超30亿人民币,海外融资金额总计超5亿美元。
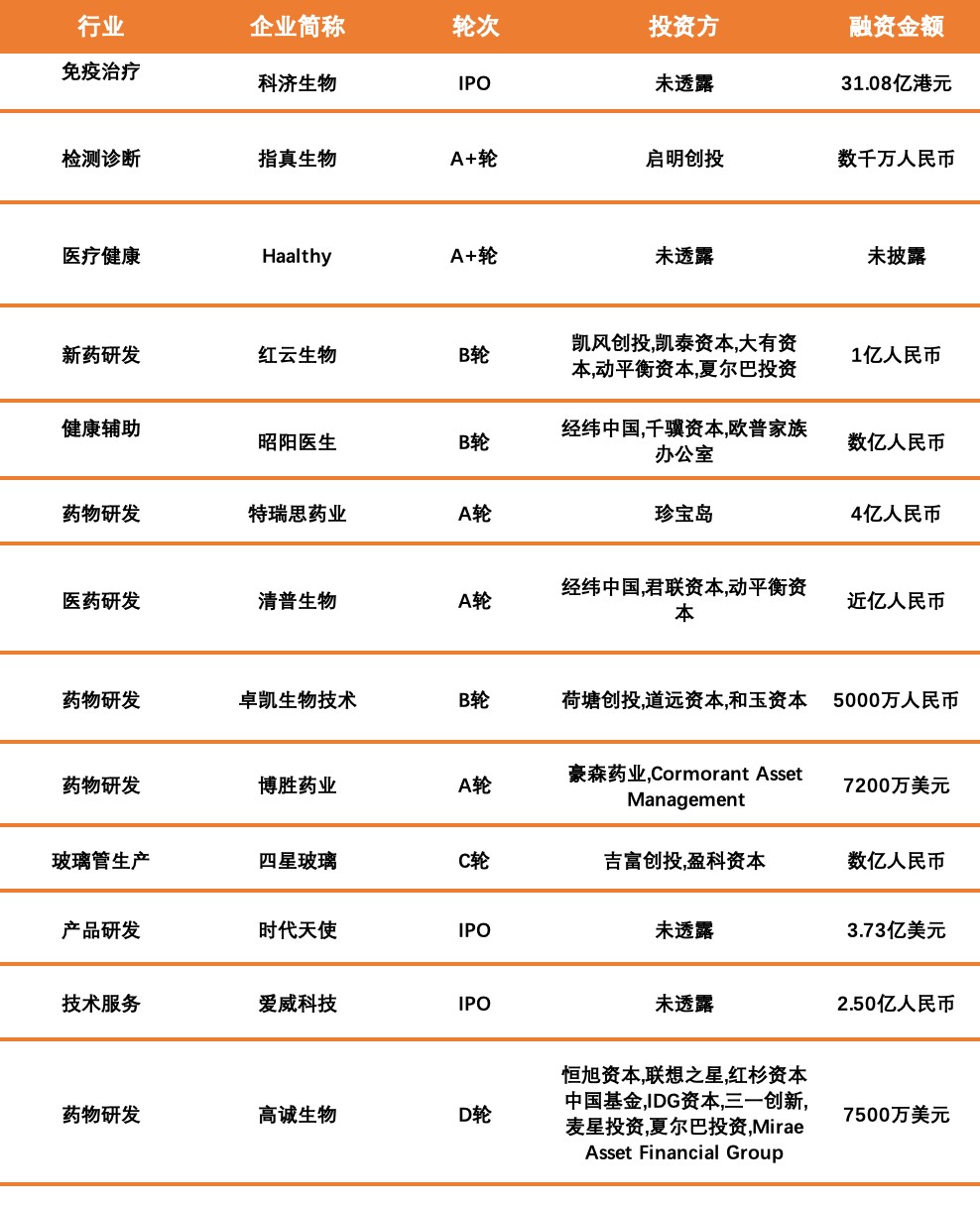
数据来源:睿兽分析
本周国内融资超1亿人民币的公司信息如下:
科济生物于2014年在上海成立,是中国及亚太地区突出的CAR-T细胞免疫治疗公司。公司开展了多个全球突出的CAR-T临床试验,向广大病患提供安全有效的CAR-T疗法,致力于帮助病人及家属战胜肿瘤。
特瑞斯药业是一家单克隆抗体类药物研发商,专注于针对癌症、自身免疫性疾病的单克隆抗体类药物的研发生产,同时涉及人源化单克隆抗体、高产超稳定细胞株的构建筛选、高蛋白滴度细胞培养、高回收率蛋白质纯化及新型蛋白质鉴定分析方法的研发工作。
时代天使生物科技有限公司于2003年成立,是一家专业从事口腔隐形正畸技术研发、隐形矫治器生产及销售的高新技术企业。公司在牙齿隐形矫治技术的研发、应用方面已获得多项国家发明专利。
爱威科技股份有限公司主营业务为医疗临床检验和诊断相关仪器及其配套试剂、试纸产品的研发、设计、制造、销售和服务。公司以“机器视觉”应用于显微镜检验自动化的技术为依托,专注于提高医疗机构的疾病检验诊断水平和效率,面向全球医疗检验诊断市场提供系统化的解决方案。
桐树基因是一家基因检测服务及产品提供商,专注于肿瘤基因检测领域,已形成基于高通量基因测序技术与生物信息分析的ctDNA精准检测体系,实现了对肿瘤无创、准确、动态的基因分析,为临床提供精准用药、疗效监测、术后复发监测、风险预测和早期检测等咨询服务。
翌圣生物科技是一家酶制剂及抗原抗体研发商,专注于酶制剂和抗原抗体研发,致力于为生命科学研究领域内的科研用户及精准医疗相关行业的工业用户提供产品和服务,产品包括PCR、qPCR、高保真DNA聚合酶、逆转录相关制剂、克隆试剂盒、高通量测序MaxUP系列DNA和RNA建库试剂盒、细胞培养、支原体检测/预防/去除试剂,以及体外诊断相关的酶原料、试剂和磁珠等。
瑞科生物是一家重大疾病基因工程疫苗研发商,致力于重大疾病基因工程疫苗的研发创新和产业化,拥有蛋白质工程和新佐剂技术创新研发技术平台。瑞科生物目前已有HPV系列疫苗、重组带状疱疹病毒疫苗、结核病疫苗、重组新冠疫苗等为代表的多条市场容量百亿级别产品线并分别处在不同研发阶段。
国外融资情况如下:
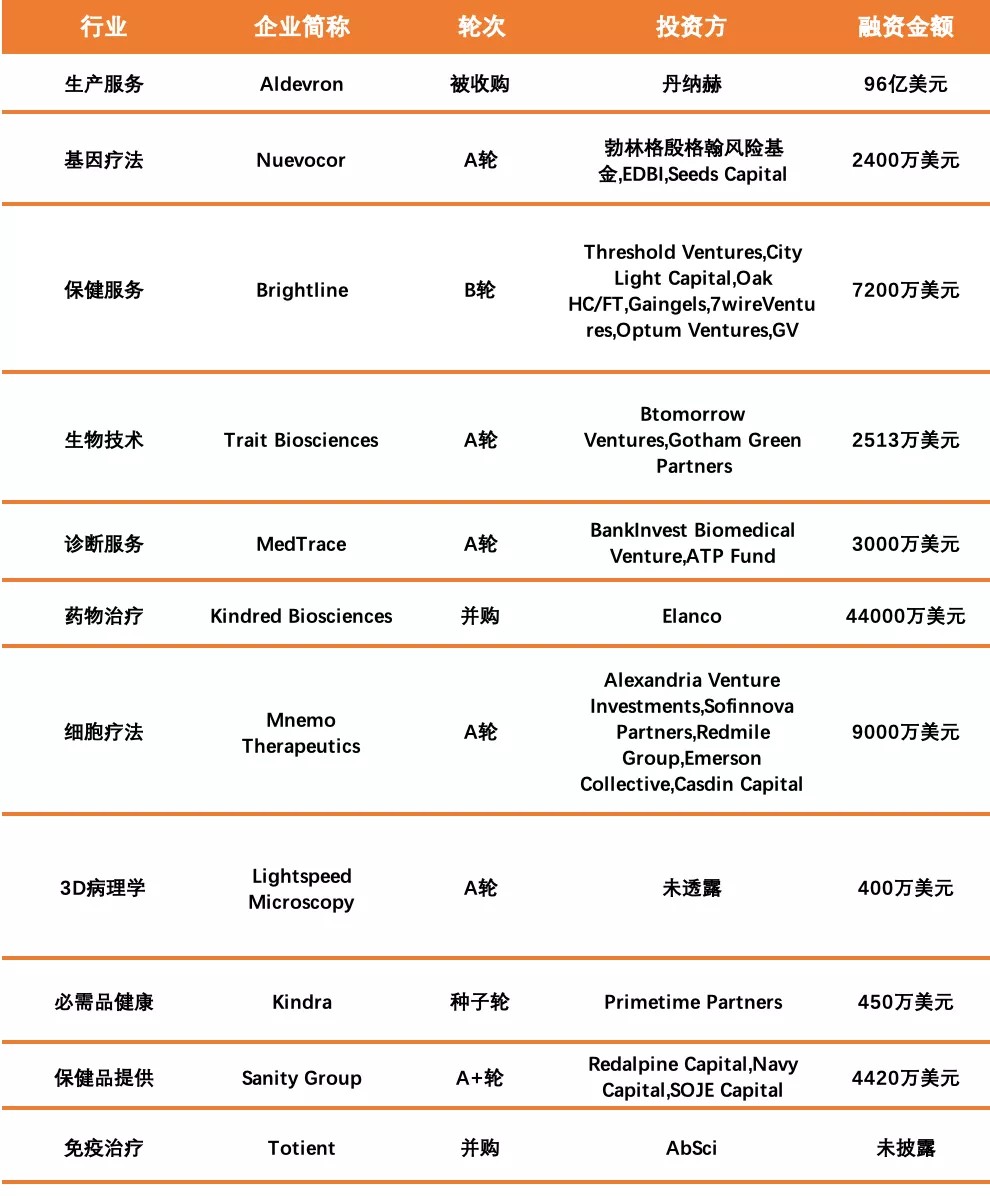
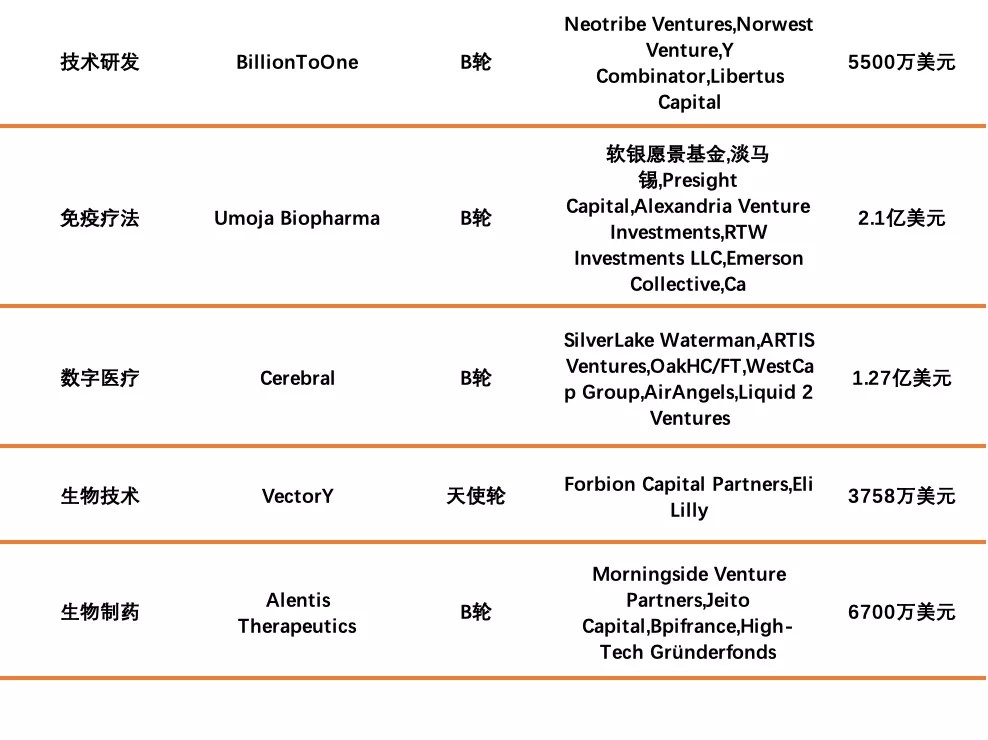
数据来源:睿兽分析
Part.2
一周政策动向
基层医师可转岗
据安徽省卫健委消息,近年来萧县为提高“基层首诊”医疗服务能力,努力建设一支高水平的医疗卫生人才队伍,在全科医生培养方面提出了新举措。其中一条举措:高校毕业到乡镇卫生院、村卫生室工作的全科医生,可按规定提前转正定级,转正定级时薪级工资高定2级。(安徽省卫健委)
医保局发布《医疗保障法(征求意见稿)》 加强价格垄断监管
15日,国家医保局发布《医疗保障法(征求意见稿)》,业界期待已久的医保大法终于揭开面纱。《医疗保障法(征求意见稿)》共分8章70条,包括总则、筹资和待遇、基金管理、医药服务、公共管理服务、监督管理、法律责任、附则等。(国家医保局)
国家药监局与香港卫生署签署新协议 有关中药检测
15日,NMPA发布公告称,近日与香港卫生署签署《关于中药检测及标准研究领域的合作安排》。NMPA将为香港中药材检测提供技术支持,双方将进一步加强在中药检测及标准研究领域的交流与合作,提升中药质量及安全水平,进一步保障公众用药安全。(NMPA)
中医药管理局印发《国家中医应急医疗队伍建设与管理指南(试行)》
15日,国家中医药管理局办公室发布一则通知,为加强国家中医应急医疗队伍建设与管理,提升国家中医应急医疗队伍的应急救治能力和水平,该局组织制定了《国家中医应急医疗队伍建设与管理指南(试行)》进行印发。(国家中医药管理局)
国务院办公厅印发《深化医药卫生体制改革2021年重点工作任务》
17日,据中国政府网消息,国务院办公厅印发深化医药卫生体制改革2021年重点工作任务。其中包括:常态化制度化开展国家组织药品集中采购,逐步扩大药品和高值医用耗材集中带量采购范围;指导地方建立健全灵敏有度的价格动态调整机制;推进医保支付方式改革,推进按疾病诊断相关分组付费、按病种分值付费试点;实施中医药振兴发展重大工程,推进国家中医药综合改革示范区建设等。(中国政府网)
Part.3
大公司&大事件
锐明新药完成近亿元A+轮融资
近日,锐明新药宣布完成近亿元A+轮融资。募集资金将主要用于公司多款产品的IND申报与临床探索和新项目的引进。(医药观澜)
宇道生物正式宣布完成2000万美元A轮融资
近日,宇道生物正式宣布完成2000万美元A轮融资,以推动其计算驱动的变构药物研发平台建设及变构候选药物的临床研发。(动脉网)
FDA前局长Stephen Hahn加入知名风投机构担任CMO
据外媒报道,FDA前局长Stephen Hahn近日将以“前沿医学和健康安全计划”首席医学官的身份加盟知名风险投资机构Flagship Pioneering。(新浪医药新闻)
裁员186人!诺华将偏头痛药Aimovig在美相关权益移交安进
本周二,诺华一位发言人表示,诺华公司将把此前共享的Aimovig在美国的联合业务运营移交给安进,包括但不限于销售、营销和医疗支持职能。因此,诺华决定削减公司原有的186个用于支持Aimovig的工作岗位。此次涉及的员工包括向诺华新泽西州东汉诺威的美国总部汇报的品牌营销和现场销售职位。(新浪医药新闻)
诚意药业拟斥6.7亿元投建海洋生物医药制造项目
16日,诚意药业公告,公司拟启动投资建设“健康产业园”二期项目,项目名称暂定为“海洋生物医药制造项目”,该项目以海洋生物医药、中医药等为主要发展方向。该项目计划投资约6.7亿元,产品方向为年产1000吨超级鱼油EPA及中药项目,主要产品包含鱼油、中药提取(梅根)、中药饮片等。(企业公告)
RayzeBio完成1.08亿美元C轮融资
15日,RayzeBio公司宣布完成数额为1.08亿美元的C轮融资,用于进一步推进其治疗癌症的靶向放射性药物研发管线。(药明康德)
Part.4
新产品&新技术
GSK/iTeos达成20亿美元 共同开发抗TIGIT抗体
近日葛兰素史克和iTeos Therapeutics公司联合宣布,双方将共同开发和推广处于1期临床开发阶段的抗TIGIT抗体EOS-448。新闻稿指出,这项合作让GSK拥有与CD226免疫检查点通路相关的三个不同靶点(TIGIT、CD96和PVRIG)的在研抗体疗法。据协议,iTeos 将获得6.25 亿美元的最后收益,以及额外的14.5 亿美元的潜在回报。(药明康德)
强生Imbruvica联合罗氏Venclexta治疗CLL/SLL三期临床试验成功
14日,据外媒报道,强生的Imbruvica联合罗氏旗下Genentech的Venclexta在一项III期GLOW研究中取得了成功,此研究评估了该联合疗法作为老年或健康状况欠佳的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤患者的一线治疗。数据显示,口服Imbruvica + Venclexta相比其他联合输注方案显示出更优越的无进展生存期。此外,研究显示Imbruvica + Venclexta可延长缓解持续时间,并显着改善患者群体的缓解深度。(新浪医药新闻)
90.4%总体保护力 重组蛋白新冠候选疫苗3期临床结果积极
14日,Novavax公司宣布,其基于重组蛋白的纳米颗粒新冠候选疫苗NVX-CoV2373在关键性3期临床试验中达到主要终点,总体保护效力为90.4%。此外,它对中度和重度COVID-19的防护效力为100%,在高风险人群中有效性为91%。而且,NVX-CoV2373对主要关注突变株/待观察突变株也表现出良好的保护效力。(药明康德)
难治性患者完全缓解率超30% CD37靶向ADC组合2期临床结果积极
14日,Debiopharm宣布其CD37靶向抗体偶联药物naratuximab emtansine,与利妥昔单抗联用,在治疗复发/难治性弥漫性大B细胞淋巴瘤的2期临床试验中获得积极结果。结果显示,组合疗法在曾经接受过2种以上前期治疗的R/R DLBCL患者中,达到31.6%的完全缓解率。(药明康德)
Avenue非阿片类止痛药tramadol 新药申请再次遭FDA拒绝
日前,美国FDA发布的一份完整回应函的详细信息显示,FDA再次拒绝批准Avenue Therapeutics静脉注射、非阿片类止痛药tramadol。在新的CRL中,FDA表示当单独给予tramadol治疗急性疼痛时,静脉治疗的不可预测性以及延迟的镇痛作用,不足以证明该疗法的收益。此外,FDA在CRL中表示,迄今为止没有足够的数据支持静脉注射tramadol与其他镇痛药物在预期批准人群中的安全性和有效性。此次CRL中没有概述tramadol相关的化学、制造和控制问题。(新浪医药新闻)
默沙东Keytruda第7项适应症在华获批 用于结直肠癌一线治疗
15日,默沙东宣布,其重磅PD-1抑制剂帕博利珠单抗已获得NMPA批准,单药用于KRAS、NRAS和BRAF基因均为野生型、不可切除或转移性高微卫星不稳定性或错配修复基因缺陷型结直肠癌患者的一线治疗。这是Keytruda在华获批的第7项适应症。(新浪医药新闻)
默沙东CTLA-4单抗进入3期临床
16日,康方生物发布新闻稿称,公司以2亿美元授权给默沙东的CTLA-4单抗quavonlimab,已经进入3期临床研究阶段。目前,一项针对晚期肾透明细胞癌一线治疗的3期临床研究已经启动,旨在探索MK-1308A联合Lenvima,对比Keytruda联合Lenvima的疗效和安全性。(医药观澜)
Part.5
言论&数据
国家药监局批准注册104个医疗器械
17日,NMPA发布公告称,5月份国家药品监督管理局共批准注册医疗器械产品104个。其中,境内第三类医疗器械产品56个,进口第三类医疗器械产品33个,进口第二类医疗器械产品13个,港澳台医疗器械产品2个。(NMPA)
本文(含图片)为合作媒体授权创业邦转载,不代表创业邦立场,转载请联系原作者。如有任何疑问,请联系editor@cyzone.cn。








